Número cuántico secundario o azimutal representado con la letra l y tiene valores posibles de l=0 y n = -1 incluido el 0.
Sí un electrón se encuentra en el orbital -2 con orientación negativa ¿los valores del número cuántico magnético y spín serían?
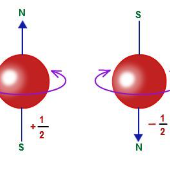
Los cuatro números cuánticos que identifican al último electrón ubicado en 3d7 son:

Cuales son los números cuánticos para 6f
n =3, l =2, ml =−1, ms =− 1/2.
¿Cuál de las siguientes distribuciones es correcta para p5 ? La distribución correcta es la respuesta e.
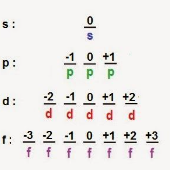
Determina la orientación espacial de la nube electrónica en respuesta al campo magnético ejercido por el núcleo atómico el ml = número cuántico magnético.
Determina el nivel energético de la región que ocupa el electrón el n: número cuántico principal
n = 6; l = 3
Define los niveles de energía de los subniveles en que se divide cada nivel principal superficie de los orbitales.
-2, -1/2
Indica el sentido de rotación del electrón el ms: número cuántico de Spin.