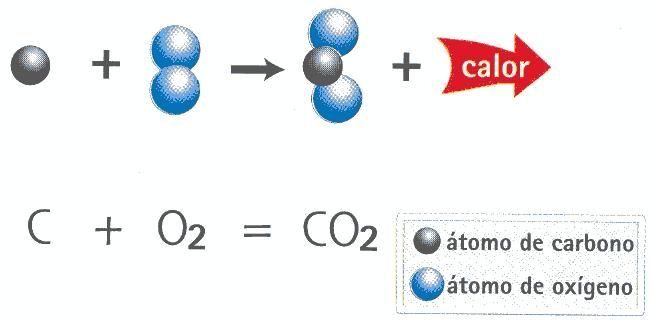
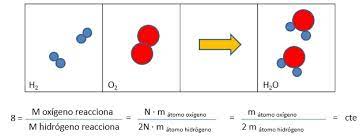
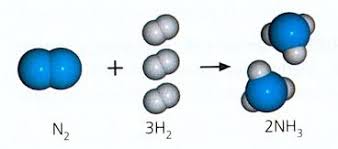
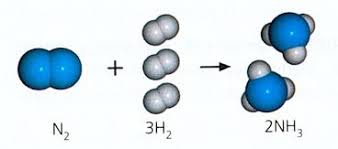
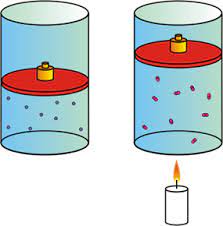
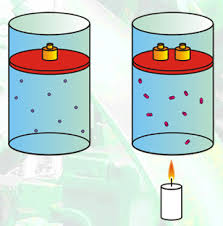
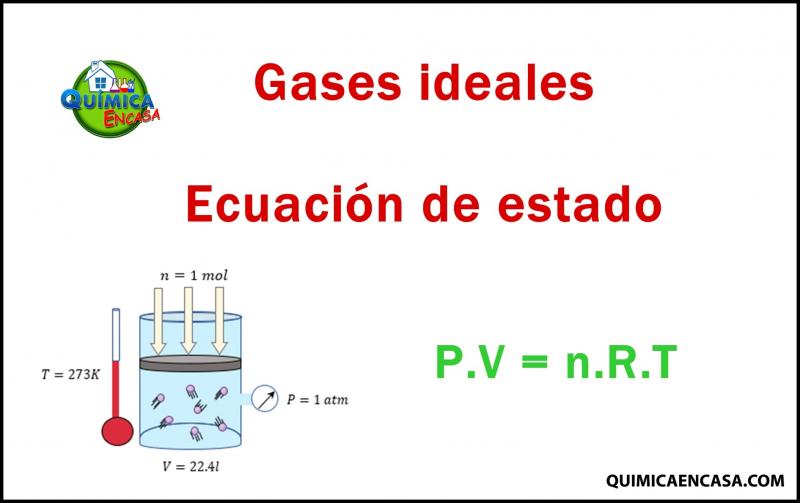
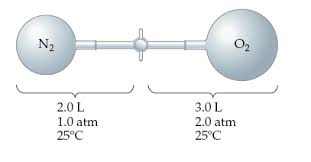
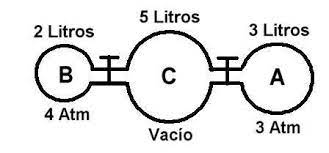
17.
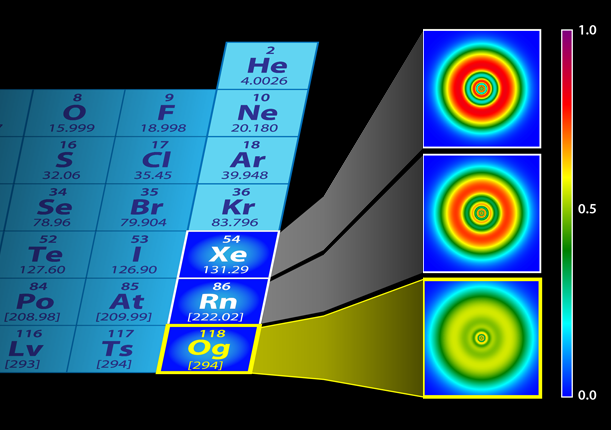
El Oganesón es el elemento químico sintético más pesado, descubierto hasta ahora, de la tabla periódica, fue sintetizado en 2002, es radiactivo y su vida media es menor de un milisegundo. Por ello, la validación experimental de esta predicción teórica es muy complicada. Calcular la masa de 1 átomo de Oganesón en Kg.