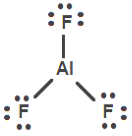
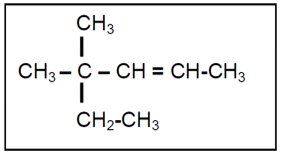
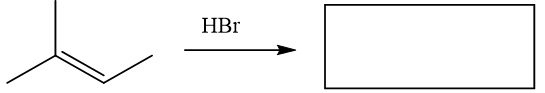
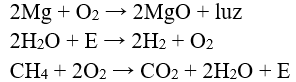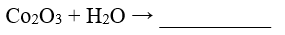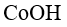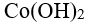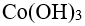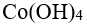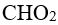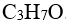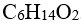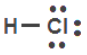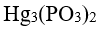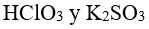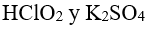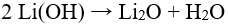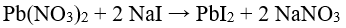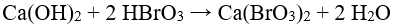48.

Una de las reacciones que ocurren, cuando se acciona la bolsa de aire (airbag) de un automóvil, es la descomposición de la azida de sodio en nitrógeno y sodio, de acuerdo con la ecuación mostrada en la imagen. Para el óptimo funcionamiento de la bolsa de aire, se requiere que al instante de la colisión se produzcan 1,5 moles de nitrógeno gaseoso, para lo cual se requiere